
Пшеничников Б.В.

Введение
1. Общий подход
2. Физические основы воздействия радиоактивного излучения на ткань
3. Биологические основы воздействия быстрых электронов на ткань
4. Облучение с постоянной мощностью
5. Зависимость от поглощенной дозы
6. Малые дозы
7. Характер развития поражения после окончания облучения
8. Основная система уравнений
9. Облучение в условиях привычного фона
10. Район погибшей клетки
11. Лучевой склероз
12. Учет более крупных разрушений сосудов
13. Общий характер поражения организма радиоактивным излучением
14. Заключение
Литература
Существующие представления не позволяют понять и объяснить, что происходит с человеческим организмом при воздействии радиоактивного излучения. В частности, не удается объяснить возникновение тех или иных болезней и пояснить, почему именно этих болезней. Естественно, не удается прогнозировать состояние пострадавших в зависимости от истории, мощности и суммарной дозы облучения, а соответственно, и успешно лечить этих больных. Основной причиной такого положения является отсутствие общей Теории радиационного поражения организма человека.
Впервые взгляды автора на физические и биологические основы поражения организма человека при малых дозах были изложены еще в начале 90-х годов (Пшеничников Б.В., 1993). Несмотря на то, что в работе излагалось лишь поверхностное упрощенное представление о протекающих процессах, было четко показано, что изменения в организме при облучении малыми дозами радиоактивного излучения имеют специфический характер. Это радиационное поражение было названо лучевым склерозом (Пшеничников Б.В., 1996, 1998).
В настоящей работе делается попытка продолжить анализ происходящих изменений в организме и предлагается "Введение в теорию радиационного поражения человека". Эта Теория позволяет понять механизм развития процесса поражения организма человека, вскрыть особенности воздействия малых доз, объяснить возможность развития комплекса различных болезней, прогнозировать изменение состояния пострадавших в зависимости от истории облучения и многое другое. Более того, впервые предоставляется возможность теоретического подхода к оценке и расчету нормативов лучевого воздействия и разработки новой Концепции радиационной защиты населения.
Прежде всего, необходимо сформулировать основные задачи, которые предстоит решить, и выбрать параметр, обеспечивающий надежную однозначную характеристику поражения организма радиоактивным излучением. В качестве такового предлагается рассматривать концентрацию погибших клеток в биологической ткани.
1.Что интересует?
1. Общий характер зависимости
поражения организма от величины дозы.
2. Особенности воздействия
облучения при малых дозах.
3. Изменение степени поражения от
облучения:
- во время воздействия
радиоактивного излучения;
- после окончания воздействия
радиоактивного излучения;
- при фоновом облучении.
2. Какие зависимости интересуют?
Зависимость концентрации погибших
клеток от:
- поглощенной дозы Q;
- мощности дозы P;
- времени облучения t;
- времени после окончания
облучения.
3.Какие факторы желательно учитывать?
Наибольший интерес представляют
зависимости от происходящих процессов:
- вероятности повреждений ДНК,
приводящих к гибели клетки;
- вероятности повреждения других биомолекул,
приводящих к гибели клетки;
- вероятности нейтрализации
антигенов, возникающих при гибели клетки;
- вероятности удаления продуктов
распада из тканей.
Прежде всего, необходимо выяснить механизм воздействия радиоактивного излучения на биологические объекты. Из всех видов только бета-частицы (быстрые электроны) воздействуют непосредственно. Все остальные сначала отдают свою энергию атомным электронам и лишь после этого посредством рождаемых ими быстрых электронов воздействуют на ткань.
Альфа-частицы и быстрые протоны производят ионизацию атомов на пути своего движения в веществе, постепенно теряя всю свою энергию, и передавая ее выбиваемым атомным электронам. Именно эти электроны и воздействуют в основном на биомолекулы, встречающиеся на их пути. Пробег тяжелых частиц в веществе составляет десятки или сотни микрометров, а быстрых электронов - миллиметры.
Нейтроны не взаимодействуют с атомами, а лишь с их ядрами, передавая свою энергию полностью или частично нуклонам ядра, которое при этом переходит в возбужденное состояние. В тех случаях, когда разрядка возбуждения ядра происходит путем испускания бета-частиц, возможно последующее непосредственное воздействие этих частиц на биоткань.
В случаях, когда возбуждение ядра снимается путем испускания гамма-квантов, возможны два основных процесса, представляющие практический интерес, комптоновское рассеяние или фотоэффект на внутренних электронных оболочках атомов. Процессы комптоновского рассеяния и фотоэффекта гамма-лучей подробно рассмотрены во многих работах, в частности, в монографии Гофмана (Джон Гофман, 1994). Третий процесс - образование пар - не имеет практического значения при анализе воздействия на вещество живой клетки радиоактивного излучения выпавших продуктов деления урана. Во всех случаях конечным продуктом ядерных превращений вновь оказываются быстрые электроны.
Таким образом, основное воздействие на живую клетку оказывают только быстрые электроны при всех видах радиоактивного облучения. Именно этот вид воздействия и представляет конкретный интерес.
Во время пролета электрона внутри клетки возможны процессы: рассеяние на электроне атома неупругое (с передачей ему части энергии) и упругое, в котором налетающий электрон не теряет свою энергию, а лишь изменяет направление полета. Основной интерес представляет именно передача атомному электрону части энергии налетающего электрона. При этом возможны разрывы молекулярных связей, и повреждения биомолекул, в том числе, и ДНК.
Усреднение энергии разрыва молекул 49-ти органических соединений, составляющей от 2 до 5 эВ, позволило выбрать применительно к биомолекулам, в том числе, к ДНК, значение, равное 4 эВ. Это заведомо больше средней величины. Разница, как предполагается, расходуется на расхождение концов ДНК в месте разрыва, что препятствует их сращиванию. Принятое значение является минимально возможным. В действительности оно может отличаться в большую сторону.
Разрыв связей молекулы ДНК включает механизм репараций в клетке. Расчеты показывают, что при дозе в 1 Гр в каждой клетке человека повреждается 5000 оснований молекул ДНК, возникает 1000 одиночных и 10-100 двойных разрывов (Ярмоненко С.П.,1988). Именно двойные разрывы, как правило, приводят к гибели клетки. Указанные здесь величины могут использоваться в дальнейшем при выполнении расчетов.
Второй вариант – повреждение, кроме ДНК в ядре, других молекул в клетке, кроме ДНК в ядре - также способен при определенных условиях приводить к ее гибели за счет агрессивных образований, рождающихся при биохимических превращениях поврежденных молекул (Джон Гофман, 1994)). Этот механизм носит цепной характер и способен самоподдерживаться даже при отсутствии облучения. Среди погибших клеток с большой вероятностью находятся клетки кровеносных и лимфатических капилляров, пронизывающих все ткани организма (Пшеничников Б.В., Иванова Н.В., 2001).
Изложенная точка зрения позволила создать математическую модель воздействия радиоактивного излучения на организм. Прежде всего, рассмотрение процесса облучения основано на следующих предположениях: (1) вся энергия радиоактивного излучения в ткани поглощается в виде энергии быстрых электронов (и только!); (2) все столкновения электронов с биомолекулами имеют независимый статистический характер; (3) разрыв биомолекул происходит в любом звене любой молекулы, оказавшейся на пути быстрого электрона; (4) часть столкновений происходит с молекулами уже погибших клеток и тем большая, чем больше таких погибших клеток; (5) затраты энергии электрона на разрыв биомолекул принимаются несколько большими, чем требуется на собственно разрыв. Предполагается, что избыток тратится на расхождение концов разрыва, что препятствует их воссоединению.
Основной вид значимого повреждения организма радиоактивным излучением - это гибель клеток различных тканей, что ведет к появлению в локальных объемах, занятых погибшей клеткой, больших количеств нативных продуктов и продуктов тканевого распада (ПТР). Поэтому целесообразно степень повреждения организма выражать через концентрацию погибших клеток, в дальнейшем обозначенную U(t).
Прежде всего, гибель клеток непосредственно при облучении зависит лишь от интенсивности потока быстрых электронов, пронизывающих клетку, и от вероятности sосуществления акта повреждения, ведущего к гибели клетки. Интенсивность потока быстрых электронов определяется мощностью дозы облучения P и характером излучения. Дифференциальное уравнение имеет вид:
dU(t)/dt=P*s. (4-1)
Решение его выражает зависимость изменения концентрации ПТР в ткани от мощности дозы облучения и вероятности гибели клетки.
U(t)=s*P*t + Uo, (4-2)
где Uo - начальная концентрация ПТР в ткани перед облучением в момент времени t=0.
Как видно из полученного выражения зависимость роста концентрации ПТР при облучении с постоянной мощностью чисто линейная. Это важный факт, хорошо подтверждаемый практикой.
Полученное уравнение (4-2) можно переписать, заменив произведение мощности дозы Р на время облучения t поглощенной дозой Q.
U(Q)=s*Q+Uo. (4-3)
Повреждения с ростом поглощенной дозы при незначительном облучении возрастают тоже линейно с коэффициентом s. А в общем случае при любых значениях дозы дифференциальное уравнение процесса имеет вид:
dU(Q)/dQ=s-j*U(Q). (5-1)
Уменьшение “полезного” эффекта на величину -j*U(Q) отражает учет возможности столкновения быстрых электронов с биомолекулами уже погибших клеток. Если бы такого эффекта не было, то в правой части уравнения оставалось бы только s. Решение дифференциального уравнения (5-1) отличается от ранее полученного.
U(Q)=(s/j)*(1-exp(-j*Q)) + Uo. (5-2)
Явный вид производной от U(Q)по Q будет:
dU(Q)/dQ=s*exp(-j*Q). (5-3)
Хорошо видно, что при массированном облучении наклон кривой зависит от Q. Он изменяется от величины s (при Q=0) до 0 (при Q близком к бесконечности), а постоянный коэффициент j характеризует скорость изменения этого наклона, или, что то же самое, скорость изменения кривизны зависимости «доза-эффект». Это есть биологическая константа, которую можно попытаться в дальнейшем определить из экспериментальных результатов. Вполне вероятно, что существует зависимость кривизны и от вида излучения, но этот факт требует отдельного рассмотрения, что не входит в рамки настоящей работы.
Приведенный ниже график дает качественное представление о характере изменения U(Q) при разных значениях j (рис.5-1).
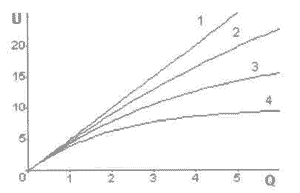
Рис.5-1.Изменение характера зависимости «доза-эффект» от коэффициента кривизны j. По осям отложены величины в относительных единицах.
На рисунке 5-1 линия 1 отражает линейную зависимость, когда j=0. Линии 2,3,4 представляют кривые с j, равным соответственно 0.005, 0.01, 0.02. Хорошо видно, что при больших величинах поглощенных доз кривые имеют четко выраженный надлинейный характер.
Данный результат подводит черту под многолетним спором специалистов о надлинейном или подлинейном характере зависимости “доза-эффект” при воздействии радиоактивного излучения на организм. Более того, теперь становится ясна одна из причин такого искривления. Полученный результат распространяется на все виды “эффектов”, обусловленных рассматриваемым лучевым воздействием.
Надлинейный характер зависимости был обоснован еще Джоном Гофманом в его фундаментальном исследовании “Рак, вызываемый облучением в малых дозах” (Гофман Джон,1994). Именно в этом труде на основе скрупулезного, ювелирного анализа имевшихся практически полученных данных о здоровье десятков тысяч жертв атомной бомбардировки японских городов автор убедительно доказал, что скорость роста заболеваемости раком с увеличением поглощенной дозы уменьшается, т.е. ход зависимости имеет именно надлинейный характер.
Таким образом, можно считать, что в данном случае теория полностью подтверждена экспериментальным результатом.
Отдельный интерес представляет вопрос о понятии “малые дозы”. Проведенный анализ общей зависимости поражения U(Q) от полученной дозы облучения позволяет решить и эту задачу.
Разложение в ряд функции exp(-j*Q) и ограничение первыми двумя членами, будет иметь вид
exp(-j*Q)=1-j*Q, (6-1)
что справедливо при малых значениях показателя экспоненты. Тогда
U(Q)=(s/j)*(1-exp(-j*Q))=(s/j)*(1-1+j*Q)=s*Q. (6-2)
Это уравнение прямой с наклоном s, т.е. начальный участок кривой представляется в виде прямой. Это важное замечание снимает все вопросы о характере зависимости "доза-эффект"; в области малых доз - он примерно линейный. Кстати, теперь можно определить и само понятие “малые дозы”, как интервал значений от 0 до Q, в котором еще допустимо считать характер изменений "доза-эффект" линейным. Кривые на рис. 6-1 иллюстрируют данное положение.
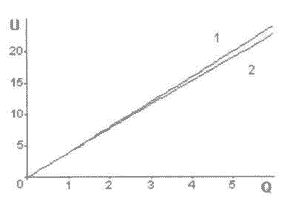
Рис. 6-1. Определение понятия «малые дозы».
1
- прямая линия с наклоном s
2 - кривая, соответствующая общему
виду зависимости при j=0,001.
На графике представлены прямая с наклоном s=1 и кривая, соответствующая общему решению (см. формулу 5-2) при j=0,001. В данном случае отклонение от прямой при максимальном значении Q=100 составляет около 5 процентов. Реально можно принять, что поглощенная доза может считаться "малой", если эффект U(Q)=(s/j)*(1-exp(-j*Q)) от ее воздействия отличается не более чем на 5% от описываемого линейной зависимостью U(Q)=s*Q при том же значении поглощенной дозы. Это будет пятипроцентный интервал U(Q), в котором дозы Q считаются "малыми".
Сразу необходимо подчеркнуть, что понятие "малые" ни в коем случае не обозначает безвредные или менее вредные! Напротив, это особый диапазон, который нуждается в подробном дополнительном анализе и описании.
До сих пор общие случаи воздействия ядерного излучения на человека рассматривались без учета реакции организма. В первую очередь, это касается других процессов, происходящих в живых клетках, подвергшихся облучению, кроме разрушения ДНК ядра.
Химические превращения поврежденных молекул в клетке среди множества различных соединений, в том числе, рождают токсины, способные воздействовать на биомолекулы с образованием опять-таки токсинов. Этот процесс является цепной реакцией, имеющей три варианта продолжения: (1) - снижение концентрации токсинов, (2) - сохранение ее на неизменном уровне или (3) - рост. Только первый вариант является благополучным и ведет к выздоровлению клетки. Второй обеспечивает консервацию поражения и, как следствие, способствует минимум развитию функциональной недостаточности клетки. Третий, в конечном итоге, приводит к гибели клетки и поражению соседних клеток.
Развитие процесса целиком зависит от начальной концентрации образовавшихся при облучении токсинов и определяется вероятностью гибели клетки (или скоростью роста числа ПТР). Концентрация токсинов полностью определяется концентрацией ПТР. Дифференциальное уравнение изменения концентрации ПТР за счет цепных биохимических процессов имеет вид:
dU(t)/dt=g*U(t). (7-1)
Его решение является чистой растущей экспоненциальной функцией.
U(t)=Uo*exp(g*t). (7-2)
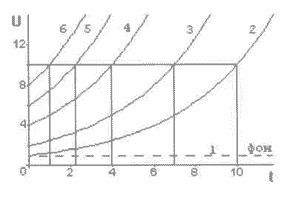
Рис. 7-1. Накопление ПТР в тканях: по оси абсцисс отложено время после облучения (годы); по оси ординат - концентрация ПТР (относительные единицы); 1 - фоновое равновесное облучение; 2 - дополнительное облучение, равное фоновому; 3-6 - дополнительное облучение кратное фоновому.
На рис. 7-1 представлен график, отражающий общий характер роста концентрации ПТР после окончания облучения. Для определенности принято значение g таким, которое обеспечивает рост в 10 раз за 10 лет при дополнительной мощности, равной фоновой. Это означает, что увеличение повреждения (рост ПТР) осуществляется примерно на 20 процентов в год. Значения на оси ординат показывают, во сколько раз начальная доза облучения Uo больше единичной.
Описываемый процесс и приведенное решение со всей очевидностью характеризуют развитие разрушительного действия последствий облучения даже после его прекращения. Этим можно объяснить продолжающееся ухудшение состояния здоровья пострадавших, однажды испытавших на себе воздействие дополнительной сверх привычного фона дозы радиоактивного излучения. Иными словами, биологический эффект от полученной дозы со временем увеличивается, что соответствует как бы увеличению дозы. Несколько неожиданный и не совсем соответствующий современным представлениям, но очень важный вывод.
Три рассмотренных варианта механизма лучевого поражения под действием радиоактивного излучения представляют три главных составных части общего процесса лучевого поражения. В реальной жизни они действуют одновременно, и учитываться должны только совместно.
Рассмотренные варианты воздействия радиоактивного излучения на организм человека есть составные части общего случая, когда учитываются реакция живого организма и основные физиологические процессы, происходящие в нем. В действительности, образующиеся в ткани ПТР частично нейтрализуются с участием присутствующих там аутоантител (ААТ) и фагоцитарной системы, частично поступают в кровь и лимфу и уносятся от места образования. Находящиеся в крови ПТР вызывают соответствующий их концентрации рост количества ААТ в крови, которые кроме нейтрализации ПТР непосредственно в крови поступают в ткань, поддерживая и там определенную концентрацию.
Концентрация ПТР в ткани повышается благодаря прямому действию быстрых электронов и токсинов биохимических реакций и, в то же время,уменьшается за счет оттока с кровью и лимфой со скоростью d, а также за счет нейтрализации присутствующими ААТ со скоростью с.
dU1(t)/dt = s*P + g*U1(t) - d1*U1(t) - c*V1(t). (8-1)
Это уравнение для ткани. Индексы относятся к обозначениям величин: 1 - для ткани и 2 - для крови. Третий член справа описывает уменьшение концентрации за счет оттока ПТР из ткани по всем возможным путям со скоростью d1. Последний член характеризует уменьшение концентрации ПТР за счет нейтрализации аутоантителами в зависимости от V1(t) концентрации ААТ и скорости с расхода аутоантител.
Похожее уравнение описывает изменение концентрации ПТР в крови U2(t). Здесь член с d2, учитывающий отток ПТР за счет очистки крови, имеет скорость оттока, не равную d1 для ткани.
dU2(t)/dt = s*P + g*U2(t) - c*V2(t) - d2*U2(t). (8-2)
Уравнение (8-3), описывающее изменение концентрации ААТ в ткани, содержит лишь два члена: поступление ААТ из крови в ткань со скоростью b в зависимости от концентрации V2(t) и потери их на нейтрализацию имеющихся ПТР со скоростью e в зависимости от концентрации ПТР в ткани U1(t).
dV1(t)/dt = b*V2(t) - e*U1(t), (8-3)
Уравнение для V2(t) - концентрации ААТ в крови - имеет дополнительный член, учитывающий скорость a образования и поступления в кровь ААТ в зависимости от концентрации ПТР в крови.
dV2(t)/dt = a*U2(t) - b*V2(t) - e*U2(t). (8-4)
Полученная система четырех уравнений описывает одновременные изменения концентрации ПТР и ААТ и в крови, и в ткани.
| dU1(t)/dt = s*P + (g - d1)*U1(t) - c*V1(t) | (8-1) |
| dU2(t)/dt = s*P + (g - d2)*U2(t) - c*V2(t) | (8-2) |
| dV1(t)/dt = b*V2(t) - е*U1(t) | (8-3) |
| dV2(t)/dt = (a - e)*U2(t) - b*V2(t) | (8-4) |
Точное полное решение системы очень громоздко и его анализ не оправдан поставленной задачей. Целесообразно рассмотреть более простые частные случаи, имеющие практическое значение.
Простейший случай представляется при облучении привычным фоном. При этом подразумевается полный баланс ПТР и ААТ и в крови, и в тканях организма, установившейся за многие годы жизни в данных условиях. Все дифференциалы в уравнениях равны 0, а сами дифференциальные уравнения превращаются в алгебраические. Сразу следует заметить, что в условиях фонового облучения скорость гибели клеток вследствие цепных биохимических процессов g дает существенно меньший вклад, чем, например, мощность дозы фонового облучения Pf. По этой причине члены уравнений с коэффициентами g очень малы, и ими на данном этапе можно пренебречь.
| 0 = s*Pf - c*V1f - d1*U1f, | (9-1) |
| 0 = s*Pf - c*V2f - d2*U2f, | (9-2) |
| 0 = b*V2f - e*U1f, | (9-3) |
| 0=(a - e)*U2f - b*V2f. | (9-4) |
Решения системы имеют вид:
| U1f = b*s*Pf / ( -c*a + c*e - d2*b)*( -a + e) / e, | (9-5) |
| U2f = -s*Pf*b / ( -c*a + c*e - d2*b), | (9-6) |
| V2f = s*Pf / ( -c*a + c*e - d2*b)*( -a + e), | (9-7) |
| V1f = *Pf*( -e*c*a + e^2*c - e*d2*b + d1*b*a - d1*b*e)/c/e/(-c*a + c*e - d2*b), | (9-8) |
| U1f = (b / e)*V2f, U2f = V2f *b / (a - e), U1f / U2 = (a - e) / e. | (9-9) |
В последней строчке (9-9) приведены соотношения, полученные из решений (9-5 – 9-8). Они имеют чисто практическое значение, устанавливая связи интересующих величин. Например, равновесную концентрацию ПТР в ткани, которую нельзя измерить никакими способами, можно определить, зная концентрацию ААТ в крови, измерение которой доступно уже сейчас. Также можно определить и концентрацию ПТР в крови, что затем позволяет подойти вплотную к определению важных биологических постоянных: a, b, c, d1, d2, e.
Решения системы уравнений для фонового облучения позволяют получить выражения для определения неизвестных на сегодняшний день, но весьма важных коэффициентов, характеризующих физиологические процессы в организме такие, как скорость перехода ПТР из ткани в кровь, зависимость концентрации ААТ в крови от мощности дозы облучения и т.д.
Следует заметить, что постоянные коэффициенты, присутствующие в фоновых уравнениях, те же самые, что и в общих дифференциальных уравнениях.
Следующий случай возможных упрощений системы дифференциальных уравнений представляется для области погибшей клетки. Здесь условия повреждения здесь капилляров и прекращение поступлений через них питательных веществ и ААТ позволяют исключить соответствующие члены из уравнений. В частности, это касается коэффициента b, который в данном предельном случае оказывается равным 0. Тогда можно заметить, что система приобретает вид:
| dU1(t)/dt = s*P + (g - d1)*U1(t) - c*V1(t), | (10-1) |
| dU2(t)/dt = s*P + (g - d2)*U2(t) - c*V2(t), | (10-2) |
| dV1(t)/dt = - e*U1(t), | (10-3) |
| dV2(t)/dt = a*U2(t) - e*U2(t). | (10-4) |
Видно, что система 4-х уравнений превратилась в две независимые из двух уравнений каждая:
| dU1(t)/dt = s*P + (g - d1)*U1(t) - c*V1(t), dV1(t)/dt = -e*U1(t). | (10-5) |
| dU2(t)/dt = s*P + (g - d2)*U2(t) - c*V2(t), dV2(t)/dt = a*U2(t) - e*U2(t). | (10-6) |
Система (10-5) описывает изменение концентрации ПТР только в ткани, а (10-6) - только в крови. В первую очередь интерес представляет изменение концентрации ПТР в ткани U1(t). Ниже в выражении для решения полученной системы уравнений приняты следующие обозначения:
T = ((g - d1)^2 + 4*c*e)^(1/2), Q = (g - d1) - T, R = (g - d1) + T. (10-7)
Тогда решения уравнений первой системы (10–5) для U1(t<) и V1(t) записываются в виде:
| U1(t) = ((P*s + 1/2*U1o*R - c*V1o)*exp(1/2*R*t) - (P*s + 1/2*U1o*Q - c*V1o)*exp(1/2*Q*t)) / T, | |
| V1(t) = ((e*U1o + 1/2*V1o*R)*exp(1/2*Q*t) - (e*U1o + 1/2*V1o*Q)*exp(1/2*R*t))/T+ +(T + (1/2)*Q*exp(1/2*R*t) - (1/2)*R*exp(1/2*Q*t))*s*P /(c*T). | (10-9) |
Графическое изображение полученного результата (10-8) для первой системы уравнений U1(t) соответствует ранее рассмотренному. Наличие дополнительного облучения мощностью Р лишь усугубляет положение и ускоряет рост концентрации ПТР в ткани.
Не меньший интерес представляет изменение концентрации аутоантител в изолированном объеме вокруг разрушенной клетки V1(t). Результат вычислений приведен на рис. 10-1.
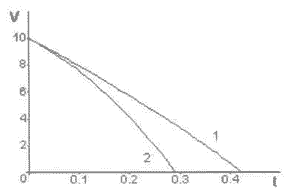
Рис. 10-1. Характер
изменения концентрации аутоантител V1(t) в изолированной области погибшей клетки.
1 - отсутствие дополнительного облучения Р = 0;
2 - наличие облучения Р > 0.
По осям отложены отностиельные единицы.
Концентрация AАТ быстро падает по мере расхода имеющихся в этом объеме аутоантител. Кривая 1 показывает уменьшение количества ААТ при отсутствии облучения, а кривая 2 - при наличии его. Результат не требует пояснений.
Полученный результат, описываемый
выражением (10-8), является исключительно важным, ключевым для понимания
механизма поражения организма человека радиоактивным излучением в малых дозах.
Нет никаких других процессов. Нет поражения органов или систем организма. Есть только
поражение ДНК , приводящее к гибели клеток или их функциональной
недостаточности. Естественно, поражение клеток мельчайших (именно, мельчайших!)
сосудов ведет к ишемическим проявлениям в районе их нахождения, что, в свою
очередь, усугубляет разрушительное действие происходящих явлений на окружающие
здоровые клетки ткани. Ход процесса, как показано на рис. 7-1, имеет
экспоненциальный характер, что ведет к лавинообразному нарастанию
количества ПТР в ткани и дальнейшему
разрушению окружающих живых клеток.
Это есть лучевой склероз.
Болезнь развивается после
повышенного по сравнению с привычным фоновым облучения и практически поражает
организм при любых дозах сверх фоновых, к которым организм
адаптирован.
Основой лучевого склероза, таким образом, является гибель клеток первоначально инициированная повышенным по сравнению с фоновым воздействием ионизирующего излучения, постоянно нарастающая и сопровождающаяся деградацией капиллярной сети.
Как следует из решений уравнений и хорошо видно на графике (рис. 7-1), болезнь развивается тем быстрее, чем выше полученная дополнительная доза Uo.
Протекающие процессы в конечном итоге ведут к склеротическим изменениям не только мельчайших, но в дальнейшем и более крупных сосудов. Таким образом, при развитии лучевого склероза, в отличие от атеросклероза, поражаются капилляры, и при общем облучении гамма-лучами процесс развивается одновременно во всех органах человека.
Выражение (10-8) после прекращения действия дополнительного облучения на пострадавших, т.е. при Р = 0 , примет более простой вид:
U1(t) = ((1/2*U1o*R - c*V1o)*exp(1/2*R*t) -
-(1/2*U1o*Q -
c*V1o)*exp(1/2*Q*t)) / T. (11-1)
В случаях повторяющегося циклического облучения необходимо рассматривать каждый раз новый отрезок времени с изменившимися условиями облучения и применять выражение (10-8) или (11-1) для концентрации ПТР в данный период времени. Все полученные таким путем результаты необходимо просуммировать. Это и будет реальная концентрация ПТР в ткани, отражающая степень лучевого поражения организма.
Проведенные теоретические исследования указывают путь, который позволяет рассчитывать единым способом и сравнивать между собой степень поражения разных отдельных пострадавших в любые моменты времени.
До сих пор рассматривалось повреждение лишь мельчайших капилляров в районе поражения клетки. В то же время рядом с ними существуют и более крупные сосуды. Кроме того, в процессе разрушения ткани за счет расширения области поражения повреждаются и соседние с ней сосуды, а также могут увеличиваться уже существующие дефекты. Так постепенно с развитием их меняются условия накопления ПТР. Постепенное увеличение числа крупных разрушений обеспечивает более быстрый отток продуктов тканевого распада из области дефекта, что меняет сам механизм течения лучевого поражения, который вступает в новую фазу - фазу массированного поступления ПТР в кровь и восстановления обменных процессов, хотя и в извращенном виде.
Таким образом, одновременно существуют два конкурирующих канала оттока ПТР. Причем, если первый - повреждение капилляров - приводит к снижению оттока ПТР и поступления ААТ в ткань из крови, то второй - крупные повреждения - напротив, обеспечивает более быстрый отток ПТР и приток ААТ. Существование второго, быстрого канала отражается на скорости d1 оттока ПТР из области поражения. Этот коэффициент превращается из постоянного, каким он рассматривался до сих пор, в функцию, зависящую от степени и величины разрушения капилляров и других сосудов, т.е. в функцию поглощенной дозы или, более точно, времени, т.е. d1 => d1(t) при облучении с постоянной мощностью.
Проводимость обоих каналов оттока есть сумма проводимостей каждого из них. Однако, для наглядности более удобно рассматривать не проводимости, а их обратные величины, т.е. сопротивления каналов оттока d1 = 1/R(t). Очевидно, первоначально сопротивление R1(t>) канала капилляров (название условное) обеспечивает нормальный ток крови. Сопротивление R2(t) канала сосудов (название условное) напротив, в начальный момент бесконечно большое из-за отсутствия больших разрушений и проводимости сквозь их стенки. По мере закупорки капилляров R1(t) растет, а проникновение ПТР сквозь разрушения в стенках сосудов увеличивается, т.е. сопротивление R2(t) уменьшается. Их суммарное сопротивление R есть
R = R1*R2 / (R1 + R2). (12-1)
Принимается, что сопротивление в случае капилляров R1(t) растет со скоростью h1, а в случае сосудов R2(t) уменьшается со скоростью h2. Значения p1o и p2o есть их начальные значения сопротивления соответственно. Тогда
R1(t) = exp(h1*t)*p1o. (12-2)
R2(t) = exp(-h2*t)*p2o. (12-3)
После алгебраических преобразований получим:
R(t) = p1o / (exp(h2*t - (h1
+ h2)*t2) + exp( -h1*t)). (12-4)
d(t) = exp(-h1*t) / p1o + exp(h2*t) / p2o.
(12-5)
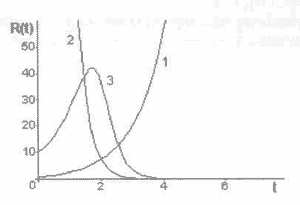
Рис. 12-1. Изменение сопротивления каналов оттока ПТР из ткани.
1 - сопротивление капилляров;
2 - сопротивление больших разрушений;
3 - суммарное сопротивление.
По осям отложены величины в относительных единицах.
На рис. 12-1 представлены графики, отражающие зависимость изменения R(t) во времени. Хорошо видно, что суммарное сопротивление со временем сначала растет, а затем резко падает. Соответственно ведет себя и процесс накопления ПТР в ткани. По мере роста дозы облучения при малой интенсивности концентрация ПТР в ткани сначала растет, и активно развивается лучевой склероз. Затем по мере увеличения больших разрушений появляется возможность ухода накопившихся продуктов тканевого распада из поврежденной области с нарастающей скоростью, что приводит к лавинообразному развитию процесса оттока. Это вызывает, с одной стороны, быструю очистку пораженной области от части избыточного накопления ПТР, а с другой стороны, резкое повышение концентрации продуктов тканевого распада в крови, что влечет за собой вспышку интоксикации и следующую за ней интенсивную продукцию ААТ.
В реальной жизни описанные процессы идут не столь стремительно, но характер изменений сохраняется.
Теперь можно просуммировать все сказанное и получить общую зависимость изменения концентрации ПТР в ткани, т.е. общий закон радиационного поражения организма радиоактивным излучением в зависимости от дозы облучения, или, что то же самое, от времени при постоянной мощности облучения, а также после его прекращения.
U1(t) = ((P*s + 1/2*U1o*R - c*V1o)*exp(1/2*R*t) -
(P*s + 1/2*U1o*Q –
c*V1o)*exp(1/2*Q*t)) / T + (s / j / P)*(1 - exp( -j*P*t) + U1o,
(13-1)
где приняты следующие обозначения:
Q = (g - d1) - T, R = (g - d1) + T, T = ((g - d1)^2 + 4*c*e)^(1/2),
d1(t) = (exp( -h1*t) / p1o + exp(h2*t) / p2o).
(13-2)
Полученный результат в виде графика изображен на рис. 13-1.
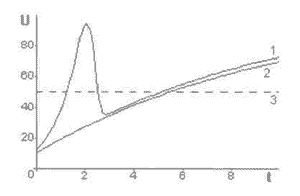
Рис. 13-1. Общий закон поражения радиоактивным излучением
организма.
1 - общая зависимость от времени при постоянной мощности облучения Р;
2 - изменение без учета лучевого склероза;
3 - уровень поражения фиксированный.
По осям отложены относительные величины.
На рис. 13-1 кривая 1 отображает общий закон поражения организма радиоактивным излучением. Ясно видна особенность в области малых доз. Следует заметить, что степень поражения U1(t), может достигать значений, которые превосходят полученные при больших дозах. Это замечание подчеркнуто на рисунке присутствием прямой 3, фиксированной величины поражения равного 50 относительным единицам. Таким образом, в области малых доз есть очень опасная область, которая отражает развитие лучевого склероза и, как теперь уже известно, даже после прекращения действия дополнительного облучения.
И еще одно интересное следствие рассмотренного механизма. А именно, есть такая область после лучевого склероза, где поражающее действие радиации меньше, чем при более низких дозах. Однако этот факт требует особого большого разговора и не обсуждается в данной работе.
Основной вывод, по-видимому, уже ясен - нет безвредных малых доз, более того, малые дозы не менее опасны, чем повышенные по сравнению с ними. Лучевой склероз есть специфическое заболевание малых доз. Он развивается с нарастающей скоростью после любого дополнительного облучения сверх привычного фона.
Следует заметить, что возможны условия облучения, когда поражения клеток носят массированный характер. Это случаи воздействия радиоактивного излучения большой мощности. В подобных условиях с большой вероятностью области погибших клеток могут оказаться достаточно близко одна от другой и даже сливаться, что соответствует рассмотренному случаю сразу больших разрушений. Причем, вероятность образования таких коллективных областей тем больше, чем больше мощность облучения. Это случаи развития острой лучевой болезни.
Однако, здесь важно подчеркнуть, что и в этих условиях массированного облучения обязательно одновременно образуются и области единичных погибших клеток. Таким образом, даже в условиях массированного облучения не исключаются условия развития лучевого склероза, хотя его значение для организма человека при этом значительно слабее, чем острой лучевой болезни до тех пор, пока не будут ликвидированы основные патологические изменения тканей из-за ОЛБ.
Здесь приведена в сокращенном изложении малая часть теории, позволяющая составить некоторое общее представление о математической модели рассматриваемых процессов. К сожалению, полностью не вошло облучение крови. Мало внимания уделено анализу поведения концентрации ААТ как в крови, так и в ткани. Не упоминается и совершенно самостоятельный раздел, касающийся специфики развития собственно болезни, ее основных характеристик: определение и расчет латентного периода, поведение организма, определение и расчет понятия кризиса болезни, анализ прогнозирования состояния больного и течения болезни, не освещен целый ряд других разделов теории. Все это невозможно изложить в докладе, даже очень большом.
Однако, представляется целесообразным закончить изложение обобщением некоторых итогов уже сказанного (лишь небольшой части из них):
(Гофман, Джон, 1994) - Гофман Джон. Рак, вызываемый облучением в малых дозах: независимый анализ проблемы. Социально-экологический союз. М. 1994. 354 сс.
(Пшеничников Б.В., 1993) - Пшеничников Б.В. Лучевое поражение и малые дозы. Ойкумена, 1993, 2: сс. 84- 93.
(Пшеничников Б.В., 1996)- Пшеничников Б.В. Малые дозы радиоактивного облучения и лучевой склероз. Издательский Дом «Соборна Украйна», Киев, 1996. 40 cс.
(Пшеничников Б.В., 1998) - Пшеничников Б.В. Малые дозы радиоактивного облучения и лучевой склероз. 2-е издание. Издательский Дом «Соборна Украйна», Киев, 1998. 48 сc.
(Пшеничников Б.В., 2001) -Пшеничников Б.В. Введение в теорию лучевого поражения человека. В: представлен в Материалы 3-й Международной конф Медицинские последствия Чернобыльской катастрофы: итоги 15-летних исследований, Киев. 2001.
(Пшеничников Б.В., Иванова Н.В., 2001) - Пшеничников Б.В., Иванова Н.В. Лучевой склероз и общее радиационное поражение организма. В: представлен в Материалы 3-й Международной конф. Медицинские последствия Чернобыльской катастрофы: итоги 15-летних исследований. Киев. 2001.
(Ярмоненко С.П., 1988) - Ярмоненко С.П. Радиобиология человека и животных. Высшая школа, Москва, 1988, 424 сс.